ここまでは理想気体について、その振る舞いを色々な側面から確認してきた。しかし実際の気体、実在気体は理想気体と同じように振る舞うわけではない。実在の気体でも、広い空間に少ない分子が存在する場合には概ね理想気体と同様の振る舞いを示す。しかし、気体の分子の各々には大きさがあり、また分子間に相互作用も存在する。たとえば分子と分子は近づきすぎると反発し、遠ざかると引力が働く。こうした力は分子間力と呼ばれ、クーロン力による引力や斥力、水素結合やファンデルワールス力などさまざまな相互作用に由来する。これらの力によって、多数の分子が存在する高圧条件では理想気体からのずれが顕著になってくる。
凝縮と臨界点
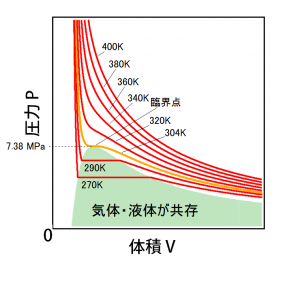
実在気体が理想気体と異なる最も顕著な効果は凝縮である。水蒸気の温度が下がると水になるように、実在の気体では温度が下がると凝縮が起きる。次のグラフは実在の気体(二酸化炭素)について、ある温度における圧力と体積の関係を描いたもの(等温線)である。
304 K 以下の温度の二酸化炭素では、温度一定で気体を圧縮(体積を小さく、圧力を高く)していくと、ある圧力で凝縮が始まる。たとえば上図の290Kの等温線を例に取ると、大きな体積から小さい体積へと線を辿っていくと緑色の領域に入るが、この境目で凝縮が始まることになる。凝縮が起きている間は、すべての気体が液体になるまで同じ圧力(蒸気圧)である。上図だと緑色の領域内の状態では容器内には液体と気体の二酸化炭素が共存して圧力が変わらないのが見て取れる。すべての気体が液体になった後(背景が緑色の領域から左に出た後)は圧力が急激に上がっていく。これは分子の大きさに由来する斥力でそれ以上の圧縮が難しいためである。
ここで、二酸化炭素の場合、304 K (31℃)よりも高い温度では凝縮が起きず、圧縮に伴って圧力が上がる一方である。凝縮が起きるのは 304 Kよりも低い温度のみである。このような温度は臨界温度と呼ばれる。また、臨界温度以上の温度の状態は、もはや液体と気体の区別がつかないため、超臨界状態とも呼ばれる。ちなみに、カフェインを含まないコーヒー豆が市販されているが、これは超臨界状態の二酸化炭素を使ってコーヒー豆からカフェインを抽出して作られている。
等温線が直線になる部分は気体と液体が共存している部分であるが、臨界温度においては、等温線は液体部分と一点で接している。この接点は臨界点と呼ばれる。臨界点における圧力は臨界圧力、1モルあたりの体積は臨界モル体積と呼ばれる。
いくつかのガスの臨界温度を下に記した。二酸化炭素の臨界温度が 304 K (31℃)ということは、この温度以下でないと液化が起きないということである。一方、プロパンやブタンの臨界温度は 100 ℃ 付近かそれ以上である。卓上コンロ用のカセットガスボンベの中身は主にノルマルブタンとイソブタンであるが、これらのガスの蒸気圧は 40 ℃ で 400~500 kPa (4~5 atm)程度であるので、ガスボンベの圧力も4気圧程度だということも分かるだろう。
| 物質 | Tc / K | Pc / MPa | ρc / kg/m3 |
|---|---|---|---|
| 二酸化炭素 | 304.21 | 7.3825 | 4661 |
| 水 | 973 | 8.5 | 1560 |
| メタン | 190.555 | 4.595 | 162.2 |
| エタン | 305.3 | 4.871 | 204.5 |
| プロパン | 369.82 | 4.250 | 217 |
| イソブタン | 408.13 | 3.648 | 221 |
| ノルマルブタン | 425.16 | 3.797 | 228 |
化学便覧 基礎編 改訂5版より