古代から人間は様々な化学反応を生活に役立ててきたが、原子や分子といった概念が現在の形で定着したのはかなり最近のことだ。分子が仮説上の存在ではなく実在するものであることが確認されたのは20世紀初頭であるし、原子に内部構造として原子核や電子があることが明らかになったのも同時期だ。その後、原子核ですら陽子や中性子でできていることがわかり、さらに20世紀後半にはその陽子や中性子もクォークやレプトン、その他の素粒子によって構成されていることが明らかになった。
このうち、化学で扱うのは主に原子より大きなスケールの領域になる。原子には様々な種類があり、質量もそれぞれ異なっていることから、19世紀にはメンデーエフが元素の周期性を見出した。このときの周期表は原子量(質量)順に並べられたものだったが、今日では元素を陽子の数、すなわち原子番号で分類することで周期表が作られている。原子番号の違いによって原子は異なる元素となり、異なる性質を持つことになる。
原子内に入ることができる電子の個数は原子番号で決まる。電子は負の電荷を持つため、正の電荷を持つ原子核内の陽子にクーロン力で引かれ、原子番号と同じ数の電子が原子内に入ることで原子は中性になる。実は、各々の元素が持つ化学的性質を実際に決定づけているのは、このようにして原子内に詰まっていった電子である。
たとえば物質の色は分子や原子がどの波長の光を吸収・放出できるかで決まってくるが、それは分子内の電子が取りうるエネルギーが関わっている。また、金属が塩酸や硫酸に溶けるときも、金属原子が水素イオン(オキソニウムイオン)に電子を渡すことで陽イオンになって溶解すると共に、電子を渡された水素イオンは水素分子となる。
一方、分子や原子の振る舞いを実際に物理法則を使って説明しようとすると、普通のニュートンの運動方程式(古典力学)では説明することができず、量子論や量子力学といった古典力学とは違う理論が必要になっている。たとえば原子内部に原子核と電子が存在するという観察結果から、正の電荷を帯びた原子核の周りを負の電荷を帯びた電子がクーロン力で引かれ、くるくると回っているというモデルを考えることができる(下図)。
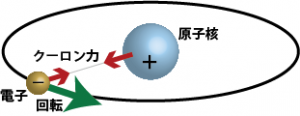
このモデルは「原子内部に正電荷を持つ原子核と負の電荷を持つ電子が存在する」…という観察結果を説明できる方法の一つではあるが、問題がある。実は、正電荷の作る電場の中で負の電荷が運動すると電磁気学の法則から電磁波が発生する。電磁波はエネルギー持っているので、原子内の電子・原子核の運動によって電磁波が発生するということは、原子内の電子と原子核の運動エネルギーが減少するということになる。そうなると、エネルギー保存の法則から電子の運動エネルギーはどんどん小さくなって、しまいには運動を止めて合体してしまうことになる。ところが観測結果によれば、現実には原子核と電子が合体しているということはないので、このモデルは使えないわけである。
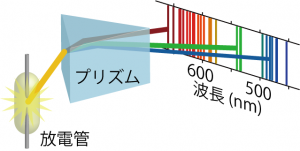
他にも、古典力学で説明できず20世紀初頭の物理学者を悩ませたものとして原子スペクトルというものがあった。ガラス管に気体を少しだけ詰めた真空管で放電現象を起こすとガラス管内が光る現象が観測されるが(現在はネオンランプとして広告に利用されることもあるし、原子吸光分光などで分析化学に利用されたりもする)、この光をプリズムで分光すると、特定の波長成分しか持っていないことがわかる。
しかも、水素原子の場合この光の波長λは次の式とよく合うことがわかった。
(1.1.1) ![]()
この式でRはリュードベリ定数と呼ばれる定数。n1, n2は整数となっていて、n1の数に応じて観測されるスペクトルにはライマン系列(n1=1)、バルマー系列(n1=2)、パッシェン系列(n1=3)という名前がついている。
さて、これら放電管から出てくる光の波長は元素によっても異なっていた。当時は原子の中に電荷を持つものが存在することはわかっていたので、放電管からの光を説明するにあたって、原子内で電子が運動することによって光が発生したと考えたのは自然なことだろう。ただ、当時の物理学では原子スペクトルが特定波長しか存在しない状況を説明することはできなかった。特定の波長の光だけが発生するためには、原子内の電子の運動エネルギーが特定のエネルギー以外の値をとれないと考えざるを得ないのであるが、当時の物理学によるモデルではこのような状況を想定することができなかったからだ。こうして、原子内の電子のエネルギーがある特定の値以外とることができない…という実験事実をも説明できる理論が求められ、編み出されていったのが量子論、そして量子力学ということになる。