より複雑な分子の場合も、水素分子イオンと同様、複数の原子の原子軌道を組み合わせた分子軌道を考えることになる。水素分子イオンと違って電子の数も複数あるので、原子軌道を組み合わせた分子軌道のエネルギーが低いものから順番に、組み立て原理に則って電子が詰まっていくと考える。
水素分子とヘリウム分子
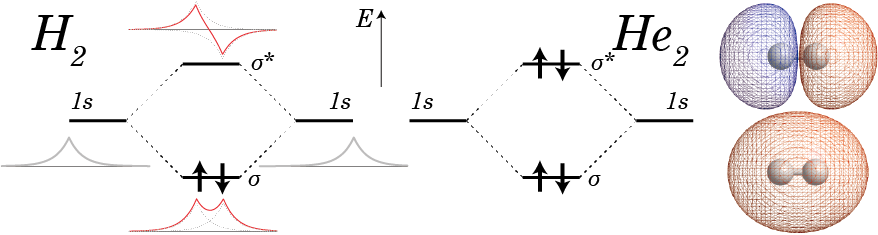
まずは等核2原子分子として水素分子を考えると、水素分子イオン同様、1s軌道から作った結合性軌道、反結合性軌道を分子軌道として考えることができる。そこで、これらの分子軌道に2個の水素原子の2個の電子が詰まっていくことになるので、2個の電子ともにはエネルギーが低い結合性軌道に入ることになる(下図)。結合性軌道のエネルギーは水素原子の1s軌道のエネルギーよりもより低いため、水素分子として存在しているほうが安定ということになる。
一方、希ガスであるヘリウムについて分子軌道に電子を詰めていくと、結合性軌道、反結合性軌道の全ての軌道が電子で埋まってしまうことになる。この状態はヘリウム原子の1s軌道に2個ずつ電子が入った時よりもエネルギー的に高い。それゆえヘリウムは原子単体で存在した方が安定ということになり、ヘリウム原子は分子を作らない。なお、ヘリウムと水素で構成された水素化ヘリウムイオン(HeH+)という分子があるが、これも結合性軌道に2個の電子が入っていることから乖離せず、星間空間などで観測されている。
窒素分子
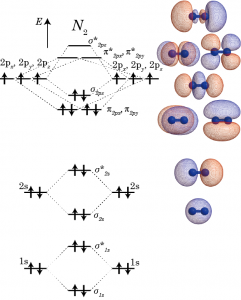
つぎに、窒素分子を考える。2個の窒素の原子軌道を組み合わせて、結合性軌道と反結合性軌道を作った時の様子を下の図で示した。軌道の重なり具合でσ結合とπ結合を形作るため、σまたはπの添え字に元になった軌道名を記している。*は反結合性軌道の印である。1s軌道同士で作られた![]() 、2s軌道同士による
、2s軌道同士による![]() は、いずれも結合性・反結合性軌道両方が電子で埋まっているため結合生成による分子のエネルギーの安定化には関与しない。
は、いずれも結合性・反結合性軌道両方が電子で埋まっているため結合生成による分子のエネルギーの安定化には関与しない。
結合による分子全体のエネルギー安定性をもたらしているのは2p軌道の結合性軌道である。窒素原子ではもともと、2p軌道のそれぞれに3個の電子が入っているが、結合を生成すると、2個の原子からの6個の電子は全て結合性軌道、![]() に入る。2個の窒素原子をz軸上に並べたときの2p軌道、すなわち2pzがσ結合を形成して、z軸とは垂直方向に伸びる2px,2py軌道がπ結合を形成した結果、3重結合になる。
に入る。2個の窒素原子をz軸上に並べたときの2p軌道、すなわち2pzがσ結合を形成して、z軸とは垂直方向に伸びる2px,2py軌道がπ結合を形成した結果、3重結合になる。
HOMOとLUMO
このように、化学反応や化学結合では、電子が詰まっている最もエネルギーが高い分子軌道が大きく関与している。電子が入っている軌道のうち最もエネルギーが高いものはHOMO(Highest Occupied Molecular Orbital:最高占有分子軌道)、電子が入っていない準位の最も低い軌道はLUMO(LUMO:Lowest Unoccupied Molecular Orbital:最低非占有分子軌道)と呼ばれる。上の図で示した窒素分子ならば、HOMOは![]() となり、
となり、![]() と
と![]() がLUMOとなる。化学反応の多くはHOMOとLUMO近傍の分子軌道間同士の電子の移動で起きるため、HOMOやLUMOは重要である。
がLUMOとなる。化学反応の多くはHOMOとLUMO近傍の分子軌道間同士の電子の移動で起きるため、HOMOやLUMOは重要である。