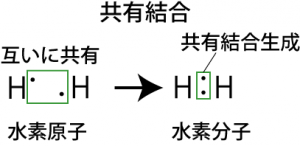
価電子とオクテット則
複数の原子が集まり、化学結合を作って結びつくことで原子は分子になるが、化学結合の生成にも電子が関わっている。特に、原子を構成する各々の軌道に詰まっている電子のうち最も外側の軌道にある電子(最外殻電子)が化学反応や化学結合では大きな役割を果たす。これは価電子とも呼ばれる*1価電子の数は希ガスの場合0個、その他の場合は最外殻電子数となる一方、希ガスの最外殻電子数は8個である。つまり価電子と最外殻電子は同義ではない。これは価電子が化学反応に関与できる電子を意味するためだ。。高校での化学において、希ガス(He, Ne, Arなど)と同じような電子状態(K殻に2個、もしくはL殻、M殻に8個の電子が詰まっている状態)は安定であり、化学反応を起こしにくいと学んだと思う。ここまでの内容でみてきたとおり、K殻に2個の電子が入っているというのは1s軌道に2個の電子が詰まっている状態、L殻やM殻に8個の電子が詰まっている状態は2sと2p、もしくは3sと3p軌道に電子が詰まった状態だ。このように、最外殻軌道のs,p軌道が8個の電子で満たされると安定になる規則はオクテット則と呼ばれる。
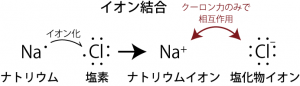
我々に馴染み深い物質を構成している元素は第2~第3周期、すなわち主量子数n が2~3の元素が多い。こうした元素では、2sと2p、または3sと3pの4つの軌道(s, px, py, pz)が最外殻軌道になるために、オクテット則により8つの電子が詰まったときに最も安定となると考えるとよい。たとえばナトリウムやカリウムなどのアルカリ金属では3s,4s軌道に1個の電子しか入っていないので、それがなくなった状態(2s,2pもしくは3s,3p軌道が8個の電子で詰まった状態)の方が安定な状態となる。それゆえアルカリ金属は1価のカチオン(陽イオン)なりやすい。逆にハロゲンの場合、たとえば塩素なら3s,3p軌道に合わせて7個の電子が入っており、p軌道にあと1個電子が入ることができる。ここに電子が入って安定な状態になったものが1価のアニオン(陰イオン)である。
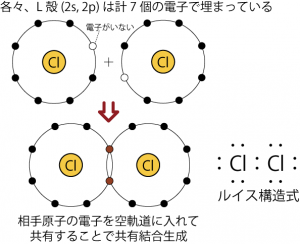
このようなオクテット則の性質:s,p軌道に8個の電子が入ることで安定になるという性質は、原子のイオン化だけでなく、原子同士が結びついて化学結合を生成するときも重要になる。原子同士が結びついて分子ができた時、その結合には色々な種類があるが、分子を構成する原子毎に見てみると結局、オクテット則のとおり8個の電子が原子核を回っているように見えるのである。例えば塩素原子が2個集まって塩素分子ができる時のことを考えると、塩素原子の2個が別々に真空中に浮かんでいるときそれぞれの原子の最外殻電子には7個の電子が入っていて、そのままでは各原子の最外殻電子が8個になる余地はない。しかし、2個の原子が一カ所にいれば、それぞれの原子はもう1つの原子から電子を1個借りてくることができるようになる。そして、このように2個の原子が互いに相手の7個目の電子を自身の8個目の電子として扱える状態のほうが2個の原子が個別に浮かんでいるときよりも安定に存在できる*22個の塩素原子が別々に存在する状態よりも、お互いの電子を共有した分子として存在する方が、トータルのエネルギーが小さい(安定)。その結果、塩素は原子ではなく、共有結合で繋がった2原子分子として存在することになる。
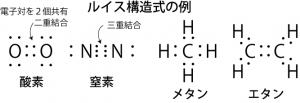
最外殻軌道の電子の数がオクテット則に沿うように原子同士の結合を考えるために考案された式が、ルイス構造式(電子式)である。高校の教科書にあったように、d軌道が関与しない原子ならば、オクテット則に従って、ルイス構造式を書いていけば大抵の分子の電子配置は表現することができる。前章で述べたように、s,p,dの各々の軌道にはスピンの異なる2個の電子が入ることができる。そこで、1個の電子しか入っていないような軌道には、他の原子の同様な境遇の電子を借りてきて、全体の電子数が8個になろうとする。こうして共有された電子は共有結合電子として、2個の原子核を共有結合でつなぎ止めることになる。
なお、オクテット則は必ずしも絶対的なものではなく、d軌道に電子が入っている第3周期以降の元素、たとえば遷移元素やリン、硫黄などでは例外も多い。d軌道の電子も合わせて考えた18電子則といったものもある。
化学結合いろいろ
実際に物質を形作っている結合にはいくつかの種類があるので、代表的な化学結合について述べておく。
イオン結合
共有結合
配位結合
金属結合
σ結合とπ結合
共有結合、配位結合では2個の原子が2個の電子(電子対)をお互いに共有することで結合が生じている。
一方、前章で見たように原子として見た場合、原子内の電子は原子軌道から決まるような確率分布をとっている。従って、2個の原子がお互いの電子を互いに共有し相手の原子の電子を借りてくるためには、共有したい電子が占める原子軌道道士がある程度重なり合っていることが必要であることが分かるだろう。また、軌道を重ねると言っても重なり方にはいろいろな種類が考えられる。それゆえ、複数の原子の原子軌道が重なりあうことで結合を形成する場合の軌道の重なり方が2つに分類され、σ結合とπ結合という名前がつけられている。
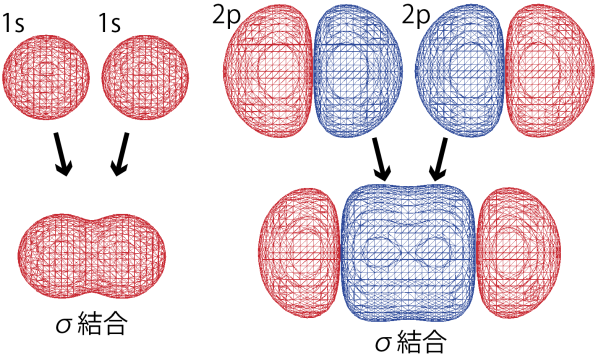
σ結合
σ結合は、原子と原子を結ぶ直線間に電子が集まることで形成される結合である。下図のように、s軌道同士、s軌道とp軌道の重なりによって、電子の存在確率が2個の原子の間で高くなることで(2つの原始で2つの軌道の電子が共有されることで)結合が形成されている。水素分子のH-H単結合はσ結合である。
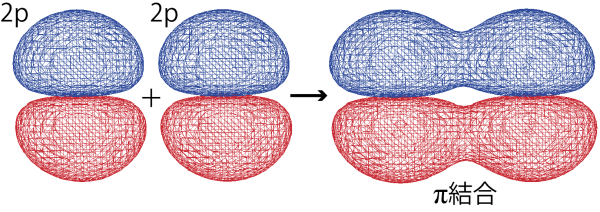
π結合
一方、π結合は2個の原子の間ではなく平行に並んだ2個の原子のp軌道が重なり合うことで生じる結合である。窒素原子の結合は三重結合であることを覚えているだろうか。窒素原子では、原子間のσ結合に加えて、1つまたは2つのπ結合が形作られることで、多重結合が形成される。