電子状態と原子スペクトル
1.1節において、水素ガスを詰めた放電管から出る水素原子スペクトルの波長は2つの整数を使って表されることを述べた。ここで出てきた2つの整数は水素原子の2つの主量子数に対応している。主量子数n1 の電子状態から主量子数n2 の電子状態に電子が遷移することで、2つの電子状態のエネルギーの差に対応する光子が放出されたのを観測したのが水素原子の原子スペクトルである。他の元素についても同様に、高いエネルギーの電子状態から低いエネルギーの電子状態に電子が遷移した時に光が放出される。ここまでの話で、水素以外の原子においても1s, 2s, 2p, 3s…といった軌道が存在し、各軌道に電子が2個ずつ詰まっていくことで原子が構成されているということを述べた。このような軌道についても、電子が入っている軌道と入っていない軌道の間を電子が遷移すると、光子を吸収したり放出したりする。水素原子との違いは、通常の原子では既に電子が詰まっている軌道があるため、その軌道に新たに電子が遷移することはできない点である*1水素原子なら、光を吸収して1s軌道から2p軌道への電子の遷移することができる。一方、ネオン原子だと2p軌道まで電子が詰まっているので1s→2p遷移はできない。。(最近は減ったが)高速道路やトンネルで光っているナトリウムランプや繁華街のネオンサイン*2屋上などの看板には、蛍光灯が仕込まれて証明されるものや発光ダイオードが並んでいるものだけでなく、発光するガラス管がクネクネと曲がった組み合わされて光るものがあり、ネオンサインと呼ばれる。これはネオンその他のガスが入った放電管である。、蛍光灯、殺菌ランプといった放電管は、原子スペクトルの発光原理を応用して光っていると共に、各原子の電子状態に応じて色が異なることになる。
イオン化エネルギーと電子親和力
電子の配置は化学反応や結合を考える上でも重要である。たとえば原子のイオン化を考えてみる。中性原子がイオン化するとき。たとえばナトリウム(Na)をナトリウムイオン(Na+)にするには、原子核のプラス電荷による束縛に打ち勝って電子を取り去る必要がある。イオン化エネルギーは、中性の原子から最外殻電子1個を取り去って陽イオンになるときに必要なエネルギーである。ナトリウムの場合、1s~2p軌道に電子が詰まった上、3s軌道にも1個の電子が入っており、この3s軌道の電子が最外殻電子*3原子に詰まっている電子の軌道のうち、最も外側のもの(もしくは電子が詰まっている軌道のうち最もエネルギー状態が高いもの)。である。従ってナトリウムのイオン化エネルギー(第1イオン化エネルギー)は3s軌道の電子を無限遠に取り去る時のエネルギーが対応する。より深い軌道にある2個目、3個目の電子を取り出すときは第2、第3イオン化エネルギーと呼ばれる。逆に、中性原子に電子が加わって陰イオンが生成するときのエネルギーは電子親和力と呼ばれる。
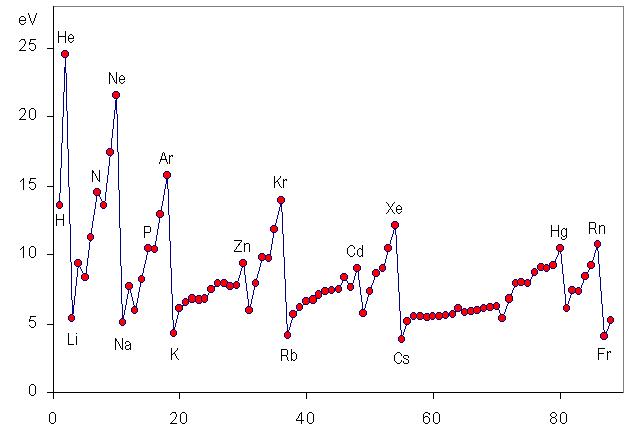
第一イオン化エネルギーを下の図に示した。Li,.Na, Kなど、反応性が高い1族の元素が最も低く、逆にHe, Neなどの反応しにくい希ガスのイオン化エネルギーが最も大きくなっている。